
科目: 来源: 题型:选择题
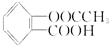 )与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
)与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A. | 1.5mol | B. | 2 mol | C. | 1 mol | D. | 0.5 mol |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 在氯乙烷中加蒸馏水,然后加入AgNO3溶液 | |
| C. | 在氯乙烷中加入乙醇,加热后酸化,然后加入AgNO3溶液 | |
| D. | 在氯乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
 |  |  |  |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增大c(A)、c(B),K增大 | |
| B. | 降低温度,正反应速率增大 | |
| C. | 该反应的焓变为负值 | |
| D. | 该反应的化学方程式为2E(g)+F(g)?A(g)+2B(g) |
查看答案和解析>>
科目: 来源: 题型:解答题
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| B. | 在101kPa时,1molH2完全燃烧生成水蒸汽,放出285.8kJ热量,H2的燃烧热为△H=-285.8kJ•mol-1 | |
| C. | 在101kPa时,1molC与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目: 来源: 题型:解答题
 2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾霾形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾霾形成的原因.| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com