
科目: 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量0.1mol•L-1盐酸 | 沉淀全部溶解,有气泡产生,说明沉淀中有碳酸钙 |
| 步骤2:往步骤1的剩余物中,再滴加几滴0.01mol•L-1 KmnO4溶液 | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目: 来源: 题型:解答题
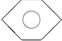 )、④甲苯(
)、④甲苯( ),
), .此反应属于取代反应.
.此反应属于取代反应.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 少量酒精在空气中挥发不见了;少量酒精在空气中燃烧后消失 | |
| B. | 块状生石灰在空气中逐渐变成粉末;晶体碳酸钠在空气中逐渐变成粉末 | |
| C. | 木炭燃烧发光、发热;电灯发光、发热 | |
| D. | 石灰水中通入少量CO2后变浑浊;室温下的饱和石灰水加热后变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com