
科目: 来源: 题型:填空题
 2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”.如图是大麻的主要成分THC的结构式.下列关于THC的说法中正确的是BEF
2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”.如图是大麻的主要成分THC的结构式.下列关于THC的说法中正确的是BEF查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与液溴混合后加入铁粉;光照甲烷与氯气的混合气体 | |
| C. | 苯与氢气在镍作催化剂的条件下反应;乙烯与水反应制乙醇 | |
| D. | 乙醇与乙酸的酯化反应;乙酸乙酯在酸性条件下的水解反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
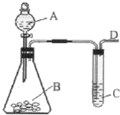 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目: 来源: 题型:解答题
 探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.
探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.查看答案和解析>>
科目: 来源: 题型:解答题
 某同学在实验室研究SO2的性质(夹持装置省略,装置内的空气已排除)
某同学在实验室研究SO2的性质(夹持装置省略,装置内的空气已排除)查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度(g/100g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.0×10-1 | 26.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低 $\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Mg2+的数目减少 | B. | Mg2+的浓度增大 | ||
| C. | 溶液pH不变 | D. | Mg(OH)2固体质量不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 | |
| C. | 向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com