
科目: 来源: 题型:多选题
| A. | 第n周期的最后一种金属元素位于第n主族(n>1) | |
| B. | 第n周期有(8-n)种非金属元素(n>1) | |
| C. | 若元素原子最外层电子数为m,电子层为n,则m-n=5的主族元素最高价含氧酸为最强酸 | |
| D. | 短周期元素中最外层电子数为2的元素一定是第ⅡA族元素 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加少量NaCl固体 | B. | 加少量NaOH | C. | 加少量CuSO4固体 | D. | 加少量Na2S固体 |
查看答案和解析>>
科目: 来源: 题型:解答题
 A为单质,B、C、D、E为与A含有相同元素的化合物,它们之间有如下转化关系:
A为单质,B、C、D、E为与A含有相同元素的化合物,它们之间有如下转化关系:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )| A. | 属于芳香族化合物 | |
| B. | 能发生消去反应和酯化反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH | |
| D. | 能分别与金属Na、NaHCO3溶液反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
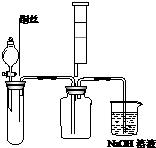 (1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.
(1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com