
科目: 来源: 题型:选择题
| A. | 第一次与100ml稀硝酸反应剩4.8g金属为Cu和Fe | |
| B. | 反应前稀硝酸的物质的量的浓度为1.5 mol•L-1 | |
| C. | 若向上述最后所得溶液中再加入足量的稀硝酸还可得到标况下0.56LNO | |
| D. | 原混合物中Cu和Fe的物质的量分别为0.06mol和0.09mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下向10mlPH=12的NaOH溶液中加入PH=2的HA至PH=7所得的溶液的总体积V≧20ml | |
| B. | 在做中和滴定实验时向滴有酚酞的NaOH溶液中滴加盐酸至溶液恰好无色,此时溶液PH<7 | |
| C. | 肥田粉溶于水所得溶液中C(NH4+)>C(SO42-)>C(H+)>C(OH-) | |
| D. | PH>7的草酸钾溶液中C(OH-)-C(H+)=4 C(H2C2O4)+2 C(HC2O4-)+2 C(C2O42-)-C(K+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向硫化钠中加入少量氯化铁S2-+2 Fe3+═2 Fe2++S↓ | |
| B. | 向Na2FeO4溶液中通入氧气和少量亚硫酸溶液10H++2 FeO42-+SO32-+O2═2Fe3++SO42-+5H2O | |
| C. | 用盐酸酸化的高锰酸钾溶液与过氧化氢反应,证明过氧化氢具有还原性:2 MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | 少量SO2通入苯酚钠溶液中2C6H5O-+SO2+H2O═C6H5OH+SO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molAl3+含有的核外电子数为3NA | |
| B. | 0.1L3mol/L的硝酸铵溶液中含有的NH4+数目为0.3NA | |
| C. | 标准状况下22.4L盐酸中一定含有0个HCl分子 | |
| D. | 100mlPH=1的醋酸溶液中含有的H+可能小于0.01NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 聚乙烯是无毒高分子,用作食品包装袋 | |
| B. | 石油的干馏得到汽油、柴油、煤油 | |
| C. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| D. | 王水是由浓盐酸和浓硝酸按3:1混合 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目: 来源: 题型:解答题

 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (CH3)2C=CHCH2CH3的名称为2-甲基-2-戊烯 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 1mol乙酰水杨酸(  )最多可以和2mol NaOH反应 )最多可以和2mol NaOH反应 | |
| D. | 可用 和HCHO 为原料合成 和HCHO 为原料合成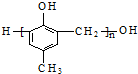 |
查看答案和解析>>
科目: 来源: 题型:选择题
 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )| A. | NH3分子内可以形成氢键,故NH3很容易液化 | |
| B. | a电极的电极反应式为:NH3-5e-+5OH-═NO+4H2O | |
| C. | 正极消耗标准状况下空气2.24L时,电池中转移的电子数目为0.4NA | |
| D. | 反应过程中,K+向b极移动.一段时间后,电解质溶液的pH将减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com