
科目: 来源: 题型:解答题

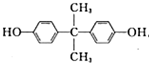 ,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯.
,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯. .
. .
. .
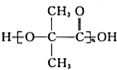
.
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气体A为SO2 | B. | 反应中共消耗Zn 97.5 g | ||
| C. | 气体A中SO2和H2的体积比为4:1 | D. | 反应中共转移3 mol电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ①②③⑥ | C. | ①③④⑤⑦ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑤⑦ | C. | ②③⑥⑦ | D. | ③④⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸混合:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 少量SO2通入到漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 往明矾溶液中加入氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2 Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 | |
| B. | 反应 ①、②、③均是氧化还原反应 | |
| C. | 反应 ②配平后,H2O的化学计量数是5 | |
| D. | 整个反应过程中每有16.8g Fe参加反应转移0.8mol电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②④⑤⑥⑦ | C. | ②④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | X、Y相对分子质量之差为84 | |
| B. | X中含有HCOO-,Y中含有-OH | |
| C. | Y的分子式为:C7H8O3 | |
| D. | 若X中有四种氢,则满足条件的X可能有两种 |
查看答案和解析>>
科目: 来源: 题型:解答题
 CuSO4在一定条件下发生如下分解:CuSO4═CuO+SO2+SO3+O2,有人设计通过实验测定反应产生的SO2,SO3,O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数.实验可能需要的仪器如图所示:
CuSO4在一定条件下发生如下分解:CuSO4═CuO+SO2+SO3+O2,有人设计通过实验测定反应产生的SO2,SO3,O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数.实验可能需要的仪器如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com