
科目: 来源: 题型:选择题
| A. | 大于2cmol/L | B. | 小于2cmol/L | ||
| C. | 等于2cmol/L | D. | 在cmol/L和2cmol/L之间 |
查看答案和解析>>
科目: 来源: 题型:解答题
| A | |||||||
| B | C | D |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | 原子半径由大到小排列顺序Z>X>Y | |
| B. | Y元素的两种同素异形体在常温下都是气体 | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
查看答案和解析>>
科目: 来源: 题型:解答题
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 ,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
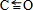 .NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.
.NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com