
科目: 来源: 题型:解答题

 )的废水可以利用微生物电池除去,其原理如图2所示.
)的废水可以利用微生物电池除去,其原理如图2所示. +2e-+H+═
+2e-+H+═ +Cl-.
+Cl-.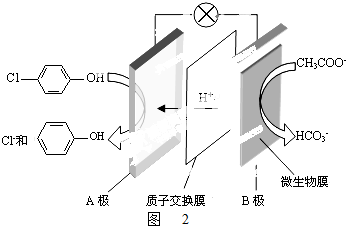
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
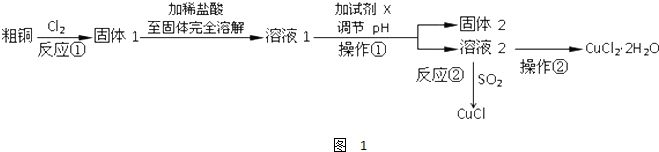

查看答案和解析>>
科目: 来源: 题型:填空题
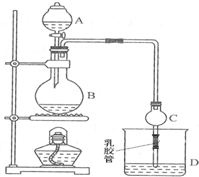 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3COOCH2CH3+H218O.
CH3COOCH2CH3+H218O.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com