
科目: 来源: 题型:选择题
| A. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,然后涂上稀硼酸溶液 | |
| B. | 过滤、结晶、焰色反应、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 检验淀粉是否发生水解,可在溶液中滴加新制氢氧化铜悬浊液,加热至沸腾,若有红色沉淀生成说明已水解,反之则没有水解 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KClO3 和SO3 溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 25℃时、用醋酸溶液滴定等浓度NaOH 溶液至pH=7,V醋酸<VNaOH | |
| C. | 向NaAlO2 溶液中滴加NaHCO3 溶液,有沉淀和气体生成 | |
| D. | AgCl 易转化为AgI 沉淀且K(AgX)=c(Ag+ )•c(X-),故K(AgI)<K(AgCl) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合气体的密度 | B. | 气体B、C的物质的量浓度之比 | ||
| C. | 气体B、D的质量之比 | D. | 气体C、D的物质的量之比 |
查看答案和解析>>
科目: 来源: 题型:填空题
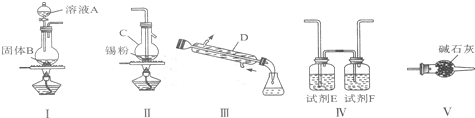
 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com