
科目: 来源: 题型:解答题
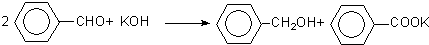
| 物质 | 沸点 | 熔点 | 溶解性 |
| 苯甲醛 | 179℃ | -26℃ | 微溶于水,能与乙醚混溶. |
| 苯甲醇 | 205.3℃ | -15.3℃ | 稍溶于水,能与乙醚混溶 |
| 苯甲酸 | 249℃ | 122℃ | 微溶于水,易溶于乙醚. |
| 乙醚 | 34.8℃ | 难溶于水 |

| 序号 | 实验方案 | 实验现象 | 结论 |
| 步骤① | 取少量产品甲于洁净的试管中,再加入2mLAg(NH3)OH 溶液,水浴加热. | 试管内壁产生光亮银镜 | 产品甲中含有苯甲醛 |
| 步骤② | 将少量产品甲置于分液漏斗中,然后向漏斗中加入饱和NaHSO3溶液,溶液,充分反应后分液. | ||
| 步骤③ | 将步骤②的有机层洗涤、干燥后,测定产品的 沸点 | 沸点为205.3℃ | 所得有机层是纯净的苯甲醇 |
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性)
实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性)查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HIn呈红色 | B. | In-呈蓝色 | ||
| C. | 加入碱溶液后n(In-)增大 | D. | HIn呈蓝色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第二次平衡时B为气态 | |
| B. | a>3 | |
| C. | 第一次平衡后增大压强平衡向左移动 | |
| D. | 第三次达到平衡时B可能为非气态 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com