
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 摩尔质量就等于物质的相对分子质量 | |
| B. | 摩尔质量就是物质相对分子质量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | CO和N2的摩尔质量相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为akJ | |
| B. | 因CuSO4•5H2O(s)═CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4(s)溶于足量水时,放出热量为bkJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+c kJ/mol | |
| D. | 因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于dkJ |
查看答案和解析>>
科目: 来源: 题型:填空题

 C
C M
M
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl④
+HCl④ +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaOH+2H2O
+2NaOH+2H2O查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
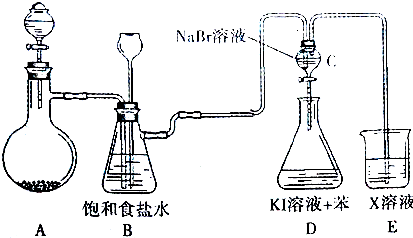
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 容器中H2O浓度与CO浓度相等 | |
| B. | 容器中H2浓度与CO浓度相等 | |
| C. | 容器中混合气体的密度保持不变 | |
| D. | CO的生成速率与H2O的消耗速率相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水的离子积Kw、随温度变化而变化,在稀盐酸中数值会变大 | |
| B. | 在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离 | |
| C. | 向水中加入NaHSO4溶液,抑制水的电离,溶液呈酸性 | |
| D. | 向水中加入NH4Cl溶液,促进水的电离,溶液呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com