
科目: 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
科目: 来源: 题型:解答题
| 相对分子量 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 26 | 161 | 微溶于水 |
| 环己酮 | 0.8102 | 0.8102 | -45 | 155.6 | 微溶于水 |
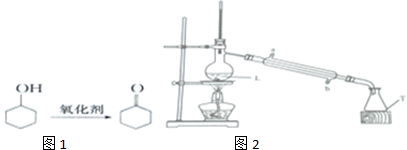
查看答案和解析>>
科目: 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.8 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
(2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:| 乙醇 | 2-羟基-4-苯基丁酸 | 2-羟基-4-苯基丁酸乙酯 | |
| 相对分子质量 | 46 | 180 | 208 |
| 状态 | 无色液体 | 白色固体 | 无色液体 |
| 沸点/℃ | 78.4 | 356.9 | 212 |
| 密度/g/cm3 | 0.789 | 1.219 | 1.075 |
| 溶解性 | 易溶于水、有机溶剂 | 能溶于水,易溶于有机溶剂 | 难溶于水,易溶于有机溶剂 |

 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c、d、f之比可能为16:1:3 | |
| B. | 一定有a=2e,b=e | |
| C. | 若n(KClO):n(KClO3)=1:1,则a、b、c、d、e、f依次为8:4:6:1:4:1 | |
| D. | 若将该方程式拆开写成两个“半反应”,其中一定有Cl2-2e-=2Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该硫酸和氨水的物质的量浓度分别约为18.4mol•L-1和6.3mol•L-1 | |
| B. | 各取5mL与等质量的水混合后,c(H2SO4)<9.2mol•L-1,c(NH3)>6.45mol•L-1 | |
| C. | 各取5mL与等体积的水混合后,ω(H2SO4)<49%,ω(NH3)>12.5% | |
| D. | 各取10mL于两烧杯中,再分别加入一定量的水即可得到较稀的硫酸溶液和氨水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 28g CO和16g O2所含的原子数都为2NA | |
| B. | 300mL 2mol/L乙醇水溶液中所含H原子数为3.6NA | |
| C. | 标准状况下,22.4L CO2和O2的混合气体含有的分子总数为NA | |
| D. | 5.6g Fe与足量Cl2反应时转移电子总数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.6mol酒精 | B. | 标准状况下4.48L SO2 | ||
| C. | 0.36g H2O | D. | 含NA个氢原子的甲烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| C. | 向FeBr2溶液中通入等物质的量的氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 酸性氧化物 | 一元酸 | 强电解质 | 分散系 | |
| A | Mn2O7 | 丙酸 | 三氧化二铝 | 黄河水 |
| B | NO2 | 高氯酸 | 盐酸 | 有色玻璃 |
| C | SiO2 | 石炭酸 | 氢氧化铝 | 云、雾 |
| D | SO2 | 硝酸 | 溴化氢 | 冰水混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com