
科目: 来源: 题型:选择题
| A. | ①② | B. | ①⑤ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgCl沉淀生成和沉淀溶解不断进行,但速率相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp增大 | |
| D. | AgCl在相同浓度的CaCl2和NaCl溶液中的溶解度相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
; (R1、R2代表烃基或氩原子)
(R1、R2代表烃基或氩原子)
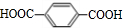 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;反应⑦的化学方程式为
+2H2O;反应⑦的化学方程式为 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3 2P+5Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |

查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 部分结构和性质 |
| A | 所有元素中原子半径最小 |
| B | 次外层电子数为最外层电子数的一半 |
| C | 单质由双原子分子构成,分子中有14个电子 |
| D | 地壳中含量最高的元素 |
| E | 最高价氧化物对应的水化物能溶于强酸和强碱 |
查看答案和解析>>
科目: 来源: 题型:选择题
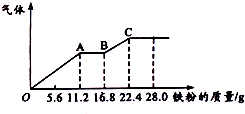 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )| A. | H2SO4浓度为5mol•L-1 | |
| B. | 第二份溶液中最终溶质为FeSO4 | |
| C. | 每份混合酸中NO3-物质的量为0.2mol | |
| D. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 0.1mol•L-1的NaHCO3溶液中C(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.1mol•L-1的NaHA溶液pH=5,则溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) | |
| D. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
查看答案和解析>>
科目: 来源: 题型:选择题
 ,有关咖啡酸的说法中不正确的是( )
,有关咖啡酸的说法中不正确的是( )| A. | 咖啡酸分子式是C9H8O4 | |
| B. | 咖啡酸可以发生还原、取代、加聚等反应 | |
| C. | 1mol咖啡酸可以与4molH2发生加成反应 | |
| D. | 1mol咖啡酸最多能消耗3molNaHCO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
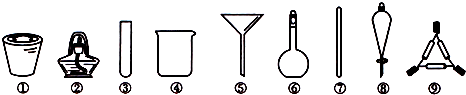
| A. | 将海带高温灼烧,选用①、②、⑨ | |
| B. | 过滤粗盐水,选用④、⑤、⑦ | |
| C. | 四氯化碳萃取溴水中的溴,选用④、⑥、⑧ | |
| D. | 加热碳酸氢钠固体并检验其产物,选用②、③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液的导电性能相同 | |
| B. | 与足量的锌粉反应的起始速率相同 | |
| C. | 与足量的锌粉反应产生氢气的体积比为1:2:100 | |
| D. | 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1:1:100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com