
科目: 来源: 题型:解答题
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如右表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如右表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生 剧烈水解 |
查看答案和解析>>
科目: 来源: 题型:解答题

| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生 剧烈水解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH- $→_{△}^{NaOH}$ CH2BrCOO-+H2O | |
| D. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=NO3-+NO↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br- | |
| C. | 甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | |
| D. | 含大量Al3+的溶液中:K+、Na+、NO3-、ClO- |
查看答案和解析>>
科目: 来源: 题型:解答题
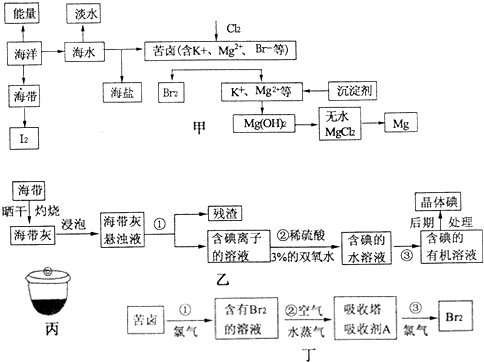
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2吸收溴单质时发生反应的化学方程式为:2H2O+SO2+Br2═H2SO3+2HBr | |
| B. | 海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2═Br2+2Cl- | |
| C. | Cl-的结构示意图为: | |
| D. | 海水中Br-的电子式为: |
查看答案和解析>>
科目: 来源: 题型:解答题

 B.
B.
 D.
D.
查看答案和解析>>
科目: 来源: 题型:解答题
 铝是地壳中含量最高的金属元素,铝及其化合物在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,铝及其化合物在生产生活中的应用日趋广泛. .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| B. | Y可以是葡萄糖溶液 | |
| C. | CuSO4在1100℃所得混合气体X中一定有O2 | |
| D. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:1 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com