
科目: 来源: 题型:选择题
| A. | 铁钉放入硫酸铜溶液中,溶液由蓝色变为浅绿色 | |
| B. | 将空气中燃着的硫伸入氧气瓶中,火焰由黄色变为蓝紫色 | |
| C. | 高温加热木炭与氧化铜的混合物,固体由黑色变成红色 | |
| D. | 往水中加入少量高锰酸钾,液体由无色变成紫红色 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高铁酸钠是一种优良的净水剂 | |
| B. | 锅炉用水的软化可以用阳离子交换法 | |
| C. | 聚氯乙烯塑料薄膜可用于制食品包装袋 | |
| D. | 若镀层被破坏镀锡的铁皮不如镀锌的铁皮耐腐蚀 |
查看答案和解析>>
科目: 来源: 题型:解答题
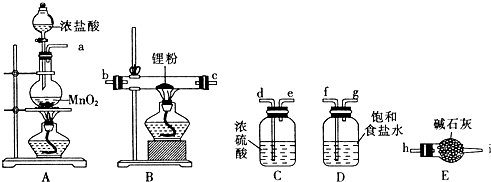
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 $→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O $\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O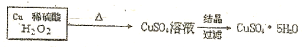 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
 .
.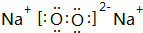 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
 ,该化合物所含化学键类型是:离子键(填“共价键”或“离子键”).
,该化合物所含化学键类型是:离子键(填“共价键”或“离子键”).| 实验步骤 | 实验现象与结论 |
| . |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com