
科目: 来源: 题型:选择题
| A. | 0.8mol•L-1 | B. | 0.4mol•L-1 | C. | 0.08mol•L-1 | D. | 0.04mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅烷的分子通式可表示为SinH2n+2 | B. | 甲硅烷燃烧生成SiO2和H2O | ||
| C. | 甲硅烷的沸点高于甲烷 | D. | 甲硅烷的稳定性比甲烷强 |
查看答案和解析>>
科目: 来源: 题型:填空题

 .
.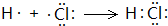 .
. ,尿素分子中σ键和π键数目之比为7:1.
,尿素分子中σ键和π键数目之比为7:1.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |

 ,化学键有离子键、共价键
,化学键有离子键、共价键
查看答案和解析>>
科目: 来源: 题型:解答题
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | X | Y | Z | W | R |
| 相 关 信 息 | 能形成+7价的化合物 | 日常生活中常见的金属,熔化时并不滴落,好像有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子,它是空气的主要成分之一 | 焰色反应为黄色 | 位于第ⅣA族,是形成化合物种类最多的元素 |


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Fe(NO3)3 溶液中滴入少量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 向AlCl3 溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Cu(OH)2沉淀溶于氨水得到深蓝色溶液:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 澄清石灰水中加入少量NaHCO3 溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com