
科目: 来源: 题型:阅读理解
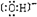
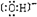
查看答案和解析>>
科目: 来源: 题型:
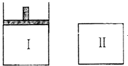 如图:Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为VL,发生如下反应并达到平衡:aX(?)+2Y(?)?3Z(g).此时II中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是( )
如图:Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为VL,发生如下反应并达到平衡:aX(?)+2Y(?)?3Z(g).此时II中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
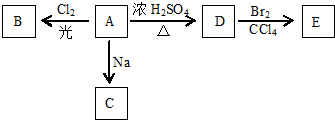
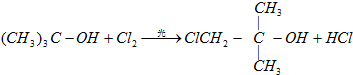
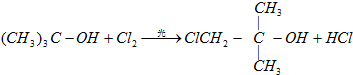


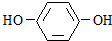





查看答案和解析>>
科目: 来源: 题型:阅读理解

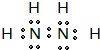
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目: 来源: 题型:
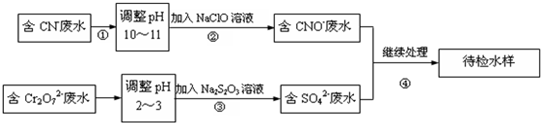
 HClO+OH-
HClO+OH- HClO+OH-
HClO+OH-查看答案和解析>>
科目: 来源: 题型:阅读理解
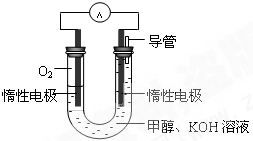 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
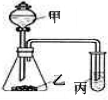
| 序 号 |
实验药品 | 实验结论 | ||
| 甲 | 乙 | 丙 | ||
| A | ① | 二氧化锰 | ② | 氧化性:O2>S |
| B | 醋酸溶液 | 碳酸钠溶液 | 硅酸钠溶液 | ③ |
| C | ④ | ⑤ | 氯化铝溶液 | 碱性:NaOH>NH3.H2O>Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com