
科目: 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X+Y?3Z(正反应吸热) | B. | 2X+Y?2Z(正反应吸热) | ||
| C. | X+Y?2Z(正反应吸热) | D. | X+2Y?4Z(正反应放热) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 )及其盐广泛应用于食品、医药、化工等领域.有一种制备乳酸方法如下:
)及其盐广泛应用于食品、医药、化工等领域.有一种制备乳酸方法如下:
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
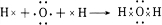 ,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能使pH试纸呈红色的溶液中:NH4+,Al3+,I-,NO3- | |
| B. | 加入Al能放出H2的溶液中:Cl-,HCO3-,NO3-,NH4+ | |
| C. | pH=1的澄清透明溶液中:Cu2+,NH4+,K+,SO42- | |
| D. | FeCl3溶液中:SCN-,Na+,AlO2-,K+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 晶体硅具有半导体性质,可用于生成光导纤维 | |
| B. | 用Na2O2漂白过的织物,麦秆日久又渐渐变成黄色 | |
| C. | K2FeO4具有氧化性,可用于自来水的杀菌消毒 | |
| D. | 浓硫酸具有较强酸性,常用作淀粉水解的催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com