
科目: 来源: 题型:选择题
| A. | 只有③④ | B. | 只有①② | C. | ①②③④ | D. | 只有②③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .
. )不能与强碱性物质混合使用,其原因是
)不能与强碱性物质混合使用,其原因是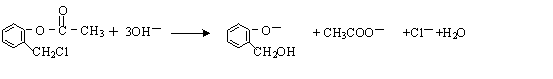 (写离子方程式).
(写离子方程式). )通过加成、取代等一系列转化合成某高分子化合物
)通过加成、取代等一系列转化合成某高分子化合物
 、
、 、
、 、
、 .
.查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 温度相同(>t1℃)时,KNO3溶液中溶质的质量分数大于NaCl溶液中溶质的质量分数 | |
| B. | t1℃时,KNO3、NaCl饱和溶液中溶质的物质的量浓度相等 | |
| C. | 用“溶解→蒸发→趁热过滤”方法可提纯含有少量KNO3杂质的NaCl固体 | |
| D. | 将50g KNO3饱和溶液从t2℃降至t1℃,析出固体质量小于0.5(b-a)g |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 仪器 | 试剂 | 实验目的 |
| A | 托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒 | 食盐,蒸馏水 | 配制一定物质的量浓度的NaCl溶液 |
| B | 烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管 | 烧碱,CO2,稀盐酸 | 除去AlCl3溶液中少量的MgCl2 |
| C | 酸式滴定管、滴管、铁架台(带铁夹) | 已知浓度的盐酸、石蕊 | 测定NaOH溶液的浓度 |
| D | 分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 | 稀盐酸,大理石,硅酸钠溶液 | 证明非金属性:Cl> C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | X | Y | Z | W |  |
| A | Cu[ | CuSO4[来 | Cu(OH)2 | CuO | |
| B | Na | NaOH | NaCl | NaHCO3 | |
| C | 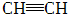 | CH2=CH2 | CH3CH3 | CH3CH2Cl | |
| D | Mg | MgO | MgSO4 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 8个中子的碳原子:12C | B. | HClO的结构式:H-Cl-O | ||
| C. | 镁离子的结构示意图: | D. | 乙酸的分子式:C2H4O2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同.
已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同.查看答案和解析>>
科目: 来源: 题型:解答题
 钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.
钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com