
科目: 来源: 题型:选择题
| A. | B单质比A单质稳定 | |
| B. | B单质和A单质互为同分异构体 | |
| C. | A单质中化学键的键能比B单质中的大 | |
| D. | 等量的A和B,A单质的内能高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  | B. | CH3-CH2-CH2-CH2-OH | ||
| C. | CH2=CHCl | D. | 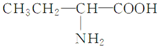 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目: 来源: 题型:多选题
 三氯生是一种抗菌剂,其结构如下图所示,遇含氯自来水能生成有毒的三氯甲烷.下列说法不正确的是( )
三氯生是一种抗菌剂,其结构如下图所示,遇含氯自来水能生成有毒的三氯甲烷.下列说法不正确的是( )| A. | 三氯生的分子式是C12H6Cl3O2 | |
| B. | 三氯甲烷与甲烷均无同分异构体 | |
| C. | 1 mol三氯生最多能与6 mol H2反应 | |
| D. | 三氯生它的相对分子质量为289.5g/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
 新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此拳治理酒驾是因酒后驾车是引发交通事故的重要原因.如图所示为交警在对驾驶员是否饮酒进行检测.其原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+.下列对乙醇的描述与此测定原理有关的是( )
新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此拳治理酒驾是因酒后驾车是引发交通事故的重要原因.如图所示为交警在对驾驶员是否饮酒进行检测.其原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+.下列对乙醇的描述与此测定原理有关的是( )| A. | ②⑤ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溴苯(液溴):加NaOH溶液,充分振荡,分液,留下层液体 | |
| B. | 乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液即可 | |
| C. | 乙烷(乙烯):通过盛有足量溴水溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,留上层液体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该分子的电子式是H:O:Cl | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | O原子发生sp杂化 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com