
科目: 来源: 题型:解答题
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| T/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化碳分子中存在共价键和分子间作用力 | |
| B. | 甲烷、氨和双氧水都是只由极性键结合而成的分子 | |
| C. | 同主族不同元素的最高价氧化物的水化物从上到下酸性递增 | |
| D. | 氟化氢的沸点高于氯化氢的沸点,水的沸点高于硫化氢的沸点 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目: 来源: 题型:解答题
 对于可逆反应2A(?)+B(g)?2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题:
对于可逆反应2A(?)+B(g)?2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 测得容器内压强增大p%,A的转化率也是p% | |
| B. | 恒容容器内平衡后再充入A(g),此平衡逆向移动 | |
| C. | 恒容容器内平衡后再充入等量的A(g),达到新平衡后,容器内压强p’为原平衡容器压强p的2倍 | |
| D. | 恒压容器内平衡后再充入Ar(g),A的转化率不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 装置图 | 所盛试剂 | 实验现象 | |
| 1 | 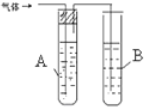 | A是 水 B是 酸性高锰酸钾溶液 | |
| 2 |  | C是 溴的四氯化碳溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com