
科目: 来源: 题型:选择题
| A. | Al(OH)3在用于治疗胃酸过多类疾病时表现出弱碱性 | |
| B. | 明矾溶于水后可得到少量的有强吸附性的Al(OH)3,故明矾可作净水剂 | |
| C. | Al(OH)3可用于中和馒头制作过程(如发酵阶段)中产生的酸 | |
| D. | Al2O3可用于制作耐火材料而Al(OH)3不能 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用含有氯化钠的融雪剂会加快桥梁的腐蚀 | |
| B. | 可溶性铜盐有毒,故人体内不存在铜元素 | |
| C. | 在海轮外壳装上锌块,可减缓船体的腐蚀速率 | |
| D. | 中秋佳节月饼中用小袋包装的铁粉来防止月饼氧化变质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | 质子数与中子数之差为50 | |
| D. | 89Y和90Y是两种不同的核素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素处于最高价态,一定具有最强的氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 还原剂失电子越多,还原性越强 | |
| D. | 在化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被还原 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. | 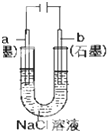 工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. | 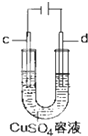 工作时,c极为发生氧化反应 | |
| D. |  电子由Zn流向Fe,装置中有Fe2+生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,20g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | 含1mol H2O的冰中,氢键的数目为4NA | |
| D. | 常温常压下,124g P4有P-P键的数目为12NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 属于高分子化合物 | B. | 水解的最终产物能与酸或碱反应 | ||
| C. | 遇浓硝酸会变性 | D. | 水解时碳氧键断裂 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 化学式 | Ag2SO4 | AgBr | AgCl |
| Ksp | 1.4×10-5 | 5.0×10-13 | 1.8×10-10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为9﹕5 | |
| C. | 若反应中转移的电子为n mol,则0.20<n<0.30 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com