
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| Ⅰ | Ⅱ | Ⅲ | |
| 备选 装置 |  |  |  |
查看答案和解析>>
科目: 来源: 题型:选择题
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br- 2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br- 2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 | |
| D. | 原混合溶液中FeBr2的物质的量为2mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硝酸能与木炭反应,证明浓硝酸既具有强氧化性又具有强酸性 | |
| B. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| C. | 高温下SiO2与Na2CO3反应生成Na2SiO3和CO2,证明硅酸酸性强于碳酸 | |
| D. | 铵盐受热都能分解,但不一定都能生成氨气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N60与N2是同素异形体 | B. | N60一定是比N2更稳定的分子 | ||
| C. | N60的相对分子质量为840 | D. | N60可能是一种很好的火箭燃料 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,结构式是F-O-O-O-F.
,结构式是F-O-O-O-F.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
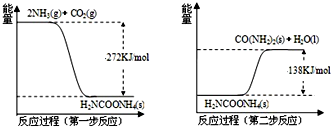
查看答案和解析>>
科目: 来源: 题型:解答题
 向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图.
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图.| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| C(mol/L) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com