
科目: 来源: 题型:解答题
 某校化学研究性学习小组,在学习了金属的知识后,探究Cu的常见化合物性质.过程如下:
某校化学研究性学习小组,在学习了金属的知识后,探究Cu的常见化合物性质.过程如下:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
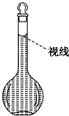 实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目: 来源: 题型:解答题
 如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题:
如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1moLAl3+离子含有的电子数为3NA | |
| B. | 1moLCl2含有1NA个原子 | |
| C. | 78g过氧化钠固体中,含有1NA个阴离子 | |
| D. | 欲配制1.00L1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L 水中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 2 mol NO和2 mol N2含原子数相同 | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com