
科目: 来源: 题型:解答题
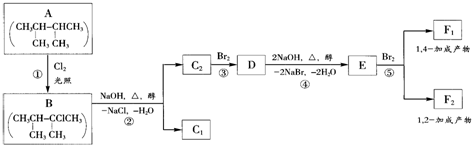
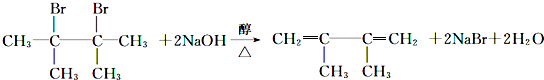 .
.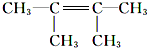 .F1的结构简式是
.F1的结构简式是 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合气体中一定有乙烯 | B. | 混合气体中一定有乙炔 | ||
| C. | 混合气体可能由丙炔和丙烯组成 | D. | 混合气体一定由乙烯和乙炔组成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.2mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目: 来源: 题型:解答题
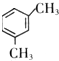 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,电离能(I)数据依次为:I1=490kJ/mol-1,I2=4562kJ/mol-1,I3=6912kJ/mol-1… |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 在第四周期元素原子中,其所含不成对电子数最多 |
 ;E基态原子的电子排布式1s22s22p63s23p63d54s1.
;E基态原子的电子排布式1s22s22p63s23p63d54s1. .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com