
科目: 来源: 题型:选择题
| A. | abdc | B. | cdba | C. | abcd | D. | dbca |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通过化学变化一定能改变物质的性质 | |
| B. | 人们所使用的材料,都是纯度越高越好 | |
| C. | 氧化还原反应中一定会发生电子转移 | |
| D. | 某元素由化合态变为游离态,该元素有可能被氧化,也有可能被还原 |
查看答案和解析>>
科目: 来源: 题型:解答题
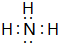 ,结构式为
,结构式为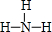 ,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32- 一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题
 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | B、C、D形成的简单离子半径大小顺序Cm+>Dn+>Bx-(m+、n+、x-表示所带电荷) | |
| B. | A、B、E气态氢化物稳定性为E>A>B | |
| C. | C和D的最高价氧化物对应的水化物之间可以发生反应 | |
| D. | E单质是制备太阳能电池的重要材料是因为E的单质导电性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com