
科目: 来源: 题型:解答题
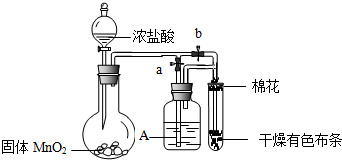
查看答案和解析>>
科目: 来源: 题型:解答题

| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 完全沉淀的pH | 3.2 | a | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | ①②③④ | B. | 只有①②③ | C. | 只有② | D. | 只有① |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第3列所含元素种类最多 | B. | 第1列元素中全为金属元素 | ||
| C. | 第15的气态氢化物为RH3 | D. | 第17列元素的第一种元素无含氧酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
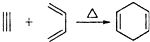 ,如果要合成
,如果要合成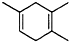 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 只有① | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜丝在空气中灼烧后迅速伸入乙醇蒸气中 | |
| B. | 铁粉与硫粉物质的量之比为1:1时混合加热 | |
| C. | 锌粉加入到氯化铜溶液中 | |
| D. | 去除氧化膜的铝条插入到浓硝酸中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素性质呈周期性变化的根本原因是元素原子半径大小呈周期性变化 | |
| B. | 碘单质溶于酒精时,共价键被破坏 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com