
科目: 来源: 题型:选择题
| A. | H2S | B. | S | C. | Fe2+ | D. | Fe3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HCl | B. | Cl2 | C. | SO2 | D. | NH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
 下列有关M的叙述中正确的是( )
下列有关M的叙述中正确的是( )| A. | M的分子式为:C12H15O5N2 | |
| B. | M可以发生水解反应、中和反应、加成反应、消去反应 | |
| C. | M的水解产物中一定含有醇类 | |
| D. | 1 molM最多可以与1L4mol/L的NaOH溶液完全反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目: 来源: 题型:选择题
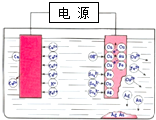
| A. | 右边电极材料为精铜 | |
| B. | 电解质溶液可选择CuSO4溶液 | |
| C. | 随着电解的进行,溶液中Cu2+浓度逐渐增加 | |
| D. | 阳极质量的减小量等于阴极质量的增加量 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 图2可能表示的是氧化镍(NiO)的晶胞 | |
| B. | 图1中C、N、O的第一电离能C>N>O | |
| C. | 图2中离镍原子最近的镍原子数共为8个 | |
| D. | 图1分子中存在的化学键有共价键、配位键、氢键 |
查看答案和解析>>
科目: 来源: 题型:选择题
 在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数减小.达到平衡时,A的体积分数小于0.5 | |
| D. | 200℃时,起始向容器中充入0.2 mol A、0.4 mol B和0.4 mol C,反应达到平衡前的速率:v(正)<v(逆) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两极共生成三种气体 | |
| B. | 阴极反应式为:Ag++e-═Ag | |
| C. | 阳极始终发生“2Cl--2e-═Cl2↑”的反应 | |
| D. | 向电解后的溶液中通入适量的HCl气体可使溶液复原到电解前的状态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素的相对原子质量递增,量变引起质变 | |
| B. | 元素原子核外电子排布呈周期性变化 | |
| C. | 元素的原子半径由大到小变化 | |
| D. | 元素的化合价呈周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com