
科目: 来源: 题型:选择题
| A. | 运用水玻璃堵塞管道,是因为水玻璃显碱性 | |
| B. | 配制碘水时,常加入少量的KI,目的是防止I2被还原 | |
| C. | 用酸化的高锰酸钾与H2O2可制取少量氧气,KMnO4作催化剂 | |
| D. | 明矾[KAl(SO4)2•12H2O]净水和液氯(Cl2)净水的原理不相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用脱硫煤和汽车尾气净化器,均可减少二氧化碳的排放 | |
| B. | 以治理细颗粒物(PM2.5)和可吸入颗粒物(PM10)为突破口,抓住能源效率、尾气排放和扬尘等关键环节,深入实施大气污染防治行动计划 | |
| C. | 电子垃圾统一回收、拆解、再利用,能够减少对土壤和水源的污染 | |
| D. | 加快淘汰钢铁、水泥、平板玻璃、电解铝等行业的落后产能 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示.
某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
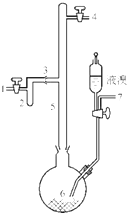 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].查看答案和解析>>
科目: 来源: 题型:解答题
 回答下列问题:
回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 min内,v(H2O2)=2 mol.L-1•min-l | |
| B. | MnOp是催化剂,能加快H2 O2的分解速率 | |
| C. | 升高温度或增大H2 O2的浓度,均能加快H2O2的分解速率 | |
| D. | 若将5 mol•L-1 H2O2溶液的体积增至6 mL,则H2O2的分解速率增至原来的2倍 |
查看答案和解析>>
科目: 来源: 题型:解答题
 可简写为
可简写为 .现有某化合物W的分子结构可表示为:
.现有某化合物W的分子结构可表示为: .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com