
科目: 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA | |
| B. | 12.8g Cu与足量HNO3反应生成NO和NO2,转移电子数目为0.4 NA | |
| C. | 0.1 mol/L的Na2CO3溶液中CO32-的个数小于0.1NA | |
| D. | 1 mol SiO2晶体中含有NA个SiO2分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用托盘天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度可以比水大也可以比水小 |
查看答案和解析>>
科目: 来源: 题型:解答题

 ,F:CH3CHO.
,F:CH3CHO. ,
, .
.查看答案和解析>>
科目: 来源: 题型:解答题
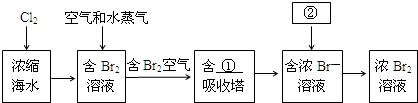
查看答案和解析>>
科目: 来源: 题型:解答题
 二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目: 来源: 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com