
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤⑥ | D. | ①②③⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 | |
| B. | CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 | |
| C. | 酸酐只含两种元素,一种为氧元素,另一种可以为金属或非金属元素,例如CO2、Mn2O7 | |
| D. | 在熔化状态下能导电的化合物为离子化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
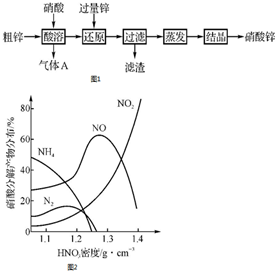 硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.
硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.查看答案和解析>>
科目: 来源: 题型:解答题
 利用如图所示的装置和其他必要的用品,利用反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O证明氨气具有还原性,请回答下列有关问题.
利用如图所示的装置和其他必要的用品,利用反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O证明氨气具有还原性,请回答下列有关问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 四种元素的最高正化合价都等于其所在的族序数 | |
| B. | X与Y、X与W分别形成的简单阴离子对水的电离的影响相似 | |
| C. | Z2W溶液呈碱性的原因可表示为W2-+2H2O?H2W+2OH- | |
| D. | X与Y、Y与Z均可形成具有强氧化性的化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作 | 灯泡亮度变化 |
| 通入CO2以前 | 亮 |
| 开始通入CO2时 | 亮变暗 |
| 恰好完全沉淀 | 至全暗 |
| 沉淀完全后,继续通入过量的CO2 | 暗变亮 |
| 再通入CO2 | 不变 |

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ν(H2)=0.03 mol•L-1•min-1 | B. | ν(NH3)=1.7 g•L-1•min-1 | ||
| C. | ν(N2)=0.02 mol•L-1•min-1 | D. | ν(NH3)=0.01 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com