
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |
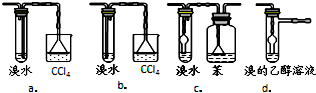

查看答案和解析>>
科目: 来源: 题型:填空题

 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 无水氯化铝是有机化工常用催化剂,其外观为白色固体,1780C时升华,极易潮解,遇 水后会发热并产生白雾.实验室用如图装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)→2A1Cl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,1780C时升华,极易潮解,遇 水后会发热并产生白雾.实验室用如图装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)→2A1Cl3+3H2.完成下列填空:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com