
科目: 来源: 题型:选择题
 被氧化为
被氧化为 和
和 ,由此推断某烯烃氧化后生成两分子CH3CHO和一分子
,由此推断某烯烃氧化后生成两分子CH3CHO和一分子 ,则原烯烃是( )
,则原烯烃是( )| A. | CH2═CHCH2CH(CH3)CH═CH2 | B. | CH3CH═CH-CH═C(CH3)2 | ||
| C. | CH3CH═CHC(CH3)═CHCH3 | D. | CH3CH═CHCH═CHCH(CH3)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| C. | Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+═Fe2++2H2O | |
| D. | H218O2中加入H2SO4酸化的KMnO4 5H218O2+2MnO4-+6H+═518O2+2Mn2++8H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98克 | |
| B. | 阿伏加德常数个微粒的物质的量是1mol | |
| C. | 1mol 12C原子的质量为12g | |
| D. | 6.02×1023mol-1是阿伏加德罗常数的近似值 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100℃水中,c(H+)•c(OH-)=1×10-14 | |
| B. | 纯水中,25℃时,c(H+)•c(OH-)=1×10-14 | |
| C. | 25℃时,任何以水为溶剂的稀溶液中c(H+)•c(OH-)=1×10-14 | |
| D. | KW值随温度升高而增大 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N的单质的晶体属于金属晶体;U的氢化物的球棍模型示意图为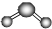 | |
| B. | 工业上V的单质的制备可以电解熔融的NV | |
| C. | Z的最高价氧化物对应的水化物能与其气态氢化物反应生成盐 | |
| D. | X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物;也可形成结构式为X-W-Y≡Z的化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过滤时玻璃棒与三层滤纸处接触 | |
| B. | 酒精和水的混合物可以通过蒸馏将二者分离开来 | |
| C. | 向试管中滴加液体时,胶头滴管应紧贴试管内壁 | |
| D. | KNO3中混有少量的NaCl,可通过重结晶实验将杂质出去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com