
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
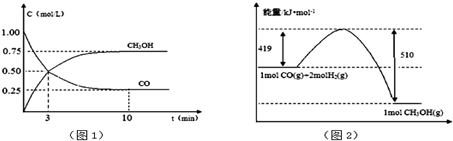
查看答案和解析>>
科目: 来源: 题型:选择题
 焚烧医药废品和生活垃圾会产生强致癌性的二噁英(结构简式如图),其沸点为302℃.下列有关判断正确的是( )
焚烧医药废品和生活垃圾会产生强致癌性的二噁英(结构简式如图),其沸点为302℃.下列有关判断正确的是( )| A. | 二噁英的摩尔质量是253 | |
| B. | 1 mol二噁英含有2mol氧原子 | |
| C. | 二噁英属于高分子化合物 | |
| D. | 1 mol二噁英在标准状况下的体积约为22.4L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若a:b=9:1,则R的化学式为FeO | |
| B. | 若a:b=1:10,则R的化学式为Fe2O3 | |
| C. | 若a:b=29:30,则R的化学式为Fe3O4 | |
| D. | 试验过程中被还原的Cl2为(10b-a)/8mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7.69mol/L 14.5% | B. | 8.15 mol/L 15.4% | ||
| C. | 7.69 mol/L 15.4% | D. | 8.17 mol/L 14.5% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一个分子中含有几个氢原子就是几元酸 | |
| B. | 分子数为NA的CO、C2H4混合气体质量为28g,标准状况下的体积约为22.4 L | |
| C. | 所含原子数相等的CO与CO2的密度之比为7:11 | |
| D. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com