
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸. | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 硫酸工业生产过程在接触室中运用热交换技术可充分利用能源 | |
| B. | 联合制碱法生产纯碱时,先通入二氧化碳,再通入氨气 | |
| C. | 氯碱工业是以利用电解食盐水生产氯气、氢气和氢氧化钠为基础的工业体系 | |
| D. | 合成氨工业汇总,加入催化剂可提高氢气的转化率 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体[ | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
;
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
| 分子式 | 溶度积Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2•6H2O呈红色,常温下稳定.110~120℃时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.1×10-36 | 3.7 |

查看答案和解析>>
科目: 来源: 题型:解答题
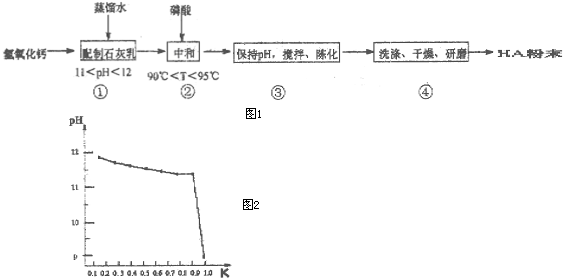
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com