
科目: 来源: 题型:解答题
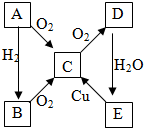 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.查看答案和解析>>
科目: 来源: 题型:解答题

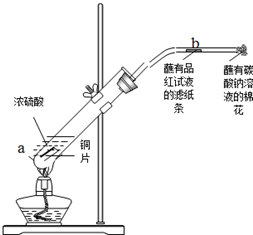
查看答案和解析>>
科目: 来源: 题型:解答题
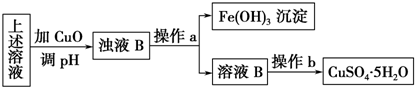
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 赤铁矿的主要成份的化学式:Fe3O4 | |
| B. | 次氯酸的电离方程式:HClO=H++ClO- | |
| C. | 氯离子的结构示意图: | |
| D. | 中子数为14的铝原子:${\;}_{13}^{14}$Al |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 人体缺铁会引起贫血等疾病 | |
| B. | 任何条件下,铝不与浓硫酸、浓硝酸反应,因此浓硫酸、浓硝酸可储存于铝制的容器中 | |
| C. | 明矾溶于水会产生氢氧化铝胶体,故可用作净水剂 | |
| D. | 铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=3v(N2) | C. | v(NH3)=3(H2) | D. | v(N2)=3V(H2) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子序数:a<b<d<c | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 单质的还原性:B>A;单质的氧化性:D>C | |
| D. | 离子的还原性:A(n+1)+>Bn+;离子的氧化性:C(n+1)->Dn- |
查看答案和解析>>
科目: 来源: 题型:解答题
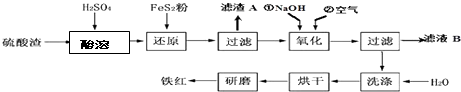
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com