
科目: 来源: 题型:解答题
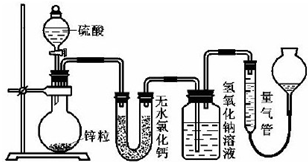
查看答案和解析>>
科目: 来源: 题型:选择题
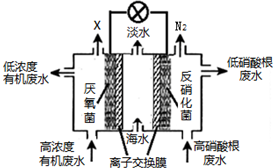
| A. | 中间室Cl-移向左室 | |
| B. | X气体为CO2 | |
| C. | 处理后的含硝酸根废水pH降低 | |
| D. | 电路中每通过4 mol电子,产生标准状况下X的体积为22.4L |
查看答案和解析>>
科目: 来源: 题型:填空题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1LH2O中溶解了0.5molNaCl,则该溶液的物质的量浓度为0.5mol•L-1 | |
| B. | 从1L1mol•L-1蔗糖(C12H22O11)溶液中取出100mL溶液,其物质的量的浓度仍为1mol•L-1 | |
| C. | 0.5mol•L-1的NaOH溶液中,含有0.5molNa+ | |
| D. | 1L H2SO4溶液中含有98g H2SO4,则该溶液的物质的量浓度为98g•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同温同压下,相同体积的气体,它们的物质的量必相等 | |
| B. | 任何条件下,等体积的O2和H2O所含的分子数必相等 | |
| C. | 1LCO气体一定比1LO2的质量小 | |
| D. | 等质量的N2和CO2两种气体的分子数一定相等 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1mol/LNH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1molH2O2分子中含极性共价键数目为0.3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入甲烷的一极为正极 | |
| B. | 通入氧气的一极发生氧化反应 | |
| C. | 标准状况下,通入3.36L的CH4,则转移0.8mol的电子 | |
| D. | 该电池在工作时,溶液中的阳离子向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com