
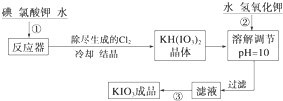
科目: 来源: 题型:解答题
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 组 别 | 猜 想 | 实验组 |
| A | 较活泼金属的氧化物催化效果好 | 氧化铁和铁丝 |
| B | 较活泼的金属单质催化效果好 | 铜丝和铁丝 |
| C | 高价的金属氧化物催化效果好 | 氧化亚铁和氧化铁 |
| D | 氧化物比单质催化效果好 | 氧化铜和铜丝 |
查看答案和解析>>
科目: 来源: 题型:解答题

| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 |
| 完全沉淀的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子半径:X2->Y->Z2+ | |
| B. | 单质的熔点:Z>W>Y | |
| C. | 能破坏水的电离平衡的离子为:Y-,Z2+,W- | |
| D. | 离子化合物ZX的熔点高,ZX可作为耐火材料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 恒压下充N2 | B. | 加B | C. | 恒容下充N2 | D. | 加A |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H20 | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H20═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:Cu+4H++2NO3-═Cu2++2NO2↑+2H20 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | Na2O液态时能导电,所以Na2O是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | 溶于水或熔融状态下能导电的化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 溶液中被沉淀的离子 | Fe3+ | Cu2+ |
| 完全生成氢氧化物沉淀时溶液的pH | ≥3.7 | ≥4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com