
科目: 来源: 题型:选择题
| A. | $\frac{pa}{m}$ | B. | $\frac{m}{pa}$ | C. | $\frac{ma}{p}$ | D. | $\frac{mp}{a}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在50mL量筒中配制0.1000mol•L-1碳酸钠溶液 | |
| B. | 仅用烧杯、量筒、玻璃棒就可以配制100mL0.1000mol•L-1K2Cr2O7溶液 | |
| C. | 用100mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100mLpH=2的盐酸 | |
| D. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余液体吸出 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | |||
| Z | W | |||
| M |
| A. | M与Y可能形成M2Y3和M2Y5化合物 | |
| B. | 原子半径大小关系:Z>X>Y | |
| C. | 不能通过电解熔融Z、W组成的物质制备Z单质 | |
| D. | Y可以形成多种氢化物,其沸点均比X与H形成的化合物高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4和CH3-CH2-CH3 | B. | C2H5-OH和C6H5-OH | ||
| C. | CH3-CH2-CH2-CH3和 | D. | C2H4和C3H4 |
查看答案和解析>>
科目: 来源: 题型:解答题
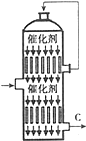 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com