
科目: 来源: 题型:解答题
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr(OH)4- | Cr3+ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 绿色 | 绿色 | 黄色 |

查看答案和解析>>
科目: 来源: 题型:解答题
 已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.
已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 生成33.6LN2(标准状况下) | B. | 被还原的N原子的物质的量为2mol | ||
| C. | 转移电子的物质的量为4 mol | D. | 还原产物比氧化产物多0.5mol |
查看答案和解析>>
科目: 来源: 题型:解答题
| Y | Z | W |
| Q |
 ,化合物X2Q的电子式为
,化合物X2Q的电子式为 .
. 2CO2(g)+S(l)△H=-136 kJ•mol-1,欲使YW的平衡转化率大于QW2的平衡转化率,则a与b的关系为a:b>1:2.
2CO2(g)+S(l)△H=-136 kJ•mol-1,欲使YW的平衡转化率大于QW2的平衡转化率,则a与b的关系为a:b>1:2.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 ,该化合物中含有的化学键有离子键、共价键
,该化合物中含有的化学键有离子键、共价键查看答案和解析>>
科目: 来源: 题型:选择题
| X | Z | |
| Y |
| A. | 原子序数由大到小为 Z>Y>X | |
| B. | 氢化物最稳定的元素为Y | |
| C. | X的最高价氧化物对应的水化物的稀溶液能与铜发生反应 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
查看答案和解析>>
科目: 来源: 题型:解答题
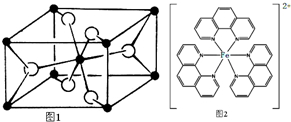
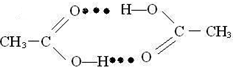 .
.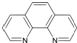 ),它能与Fe2+形成红色配合物(如右图2),
),它能与Fe2+形成红色配合物(如右图2),查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞试液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③用小刀切割一小块钠擦干煤油后放入滴有酚酞试液的装有冷水的烧杯中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将打磨后的镁投入装有稀盐酸的试管中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将打磨后的铝投入装有稀盐酸的试管中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com