
科目: 来源: 题型:解答题
 回答下列问题.
回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=4的盐酸中:c(H+)=4.0mol•L-1 | |
| B. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| C. | NaCl溶液中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=2c(Na+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO(g)的燃烧热:△H=-283.0KJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=-556.0KJ/mol | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.30KJ/mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3KJ的热量 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H=a; 2C(s)+O2(g)=2CO(g);△H=b,则a>b | |
| D. | 已知c(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 用pH计测得某溶液的pH为2.2 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
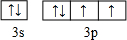 .
.
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.0 mol/L | B. | 0.50 mol/L | C. | 2.0 mol/L | D. | 无法计算 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2K+2H2O═2KOH+H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2H2O2═2H2O+O2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com