
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
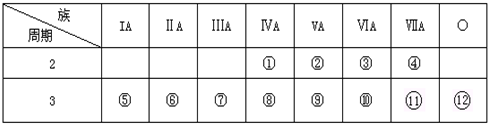
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑬ | ① | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ;
; ,元素⑬最高价氧化物的电子式
,元素⑬最高价氧化物的电子式 ;③与⑦两元素形成某种化合物,用电子式表示其形成过程
;③与⑦两元素形成某种化合物,用电子式表示其形成过程 .
.查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原气体中一定含有NH3、CO2、NO | B. | 原气体中一定不含有HCl、H2、NO2 | ||
| C. | 原气体中可能含有HCl、H2 | D. | 原气体中CO2和NO物质的量比为3:2 |
查看答案和解析>>
科目: 来源: 题型:解答题
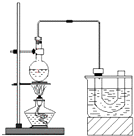 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:查看答案和解析>>
科目: 来源: 题型:解答题
| M | |
| T |
 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 从图1可知H3PO4、HPO42-、PO43-不能大量共存,0.01mol•L-1NaH2PO4溶液中c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | PO43-+H2O?0H-+HPO42-的平衡常数为10-1.7 | |
| C. | 从a点到b点的反应为H2PO4-+OH-=HPO42-+H2O,可以选用pH计确定滴定终点,无需添加指示剂 | |
| D. | 在Na2HPO4溶液中存在c(Na+)+c(OH-)=c(H+)+c(PO43-)+2c(HPO42-)+3c(H2PO4-)+4c(H3PO4) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 章鱼胺的结构为 ,其分子式为C8H12NO2 ,其分子式为C8H12NO2 | |
| B. | 鸡蛋白可溶于水,加浓硫酸钠溶液和福尔马林均可使鸡蛋白溶液聚沉,但原理不同 | |
| C. | 葡萄糖、蔗糖、淀粉都属于糖类,三者互为同系物 | |
| D. |  与足量H2反应的产物为3-甲基-2-乙基戊烷 与足量H2反应的产物为3-甲基-2-乙基戊烷 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com