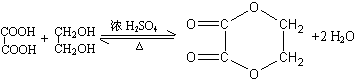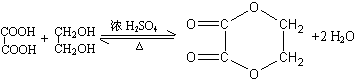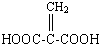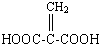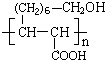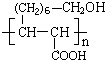(1)某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是
ABD
ABD
.
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、配制溶液时,若在最后一次读数时俯视读数,则导致最后实验结果偏大.
F、中和滴定时,若在最后一次读数时俯视读数,则导致最后实验结果偏大.
(2)常温下,已知0.1mol?L
-1一元酸HA溶液中c(OH
-)/c(H
+)=1×10
-8.
①常温下,0.1mol?L
-1 HA溶液的pH=
3
3
;写出该酸(HA)与NaOH溶液反应的离子方程式:
HA+OH-═A-+H2O
HA+OH-═A-+H2O
;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:
c(A-)>c(Na+)>c(H+)>c(OH-)
c(A-)>c(Na+)>c(H+)>c(OH-)
;
③0.2mol?L
-1HA溶液与0.1mol?L
-1NaOH溶液等体积混合后所得溶液中:
c(H
+)+c(HA)-c(OH
-)=
0.05
0.05
mol?L
-1.(溶液体积变化忽略不计)
(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数K
w=
1.0×10-13
1.0×10-13
.
①该温度下(t℃),将100mL 0.1mol?L
-1的稀H
2SO
4溶液与100mL 0.4mol?L
-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
12
12
.
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pH
a)与NaOH溶液的pH(pH
b)的关系是:
pHa+pHb=12
pHa+pHb=12
.

 +4Cu(OH)2
+4Cu(OH)2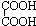 +2Cu2O↓+4H2O
+2Cu2O↓+4H2O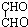 +4Cu(OH)2
+4Cu(OH)2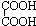 +2Cu2O↓+4H2O
+2Cu2O↓+4H2O