
科目: 来源: 题型:选择题
| A. | 二氧化硅是良好的半导体材料,可用于制造集成电路、晶体管器件和硅芯片等 | |
| B. | 硅的化学性质很稳定,常温下与酸、碱、盐等难以反应 | |
| C. | 硅酸俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 向含有少量酚酞的硅酸钠溶液中逐滴加入稀盐酸,边加边振荡,可以看到溶液红色逐渐消失 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| B. | 淀粉和纤维素的化学式都是(C6H10O5)n,因此它们互为同分异构体 | |
| C. | 分馏煤焦油可以得到苯和甲苯,说明煤中含有苯和甲苯等芳香烃 | |
| D. | 乙烯、苯、四氯化碳分子中所有原子都在同一平面上 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨气在反应中得到电子,表现还原性 | |
| B. | 有1molN2生成时,反应中转移电子数为6NA | |
| C. | 氧化产物与还原产物的质量之比为4:3 | |
| D. | 该反应中各物质均属于非电解质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 小苏打电离方程式:NaHCO3+H2O?Na++H3O++CO32- | |
| B. | 丙烷分子的球棍模型: | |
| C. | 氮气化学性质稳定是因为其分子中含有氮氮三键,电子式为 | |
| D. | 核内含有1个质子和1个中子的原子可表示为:${\;}_{1}^{1}$H |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不需要通过化学反应就能从海水中获得食盐和淡水 | |
| B. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 | |
| C. | 聚乙烯塑料和聚氯乙烯塑料都是利用缩聚反应制得的 | |
| D. | 玻璃、陶瓷、水泥是重要的传统硅酸盐产品 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ⑩ | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
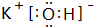 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.
结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com