
科目: 来源: 题型:解答题
 正丁醚(C4H9OC4H9)是惰性溶剂,常用作有机合成反应溶剂.某实验小组利用如图装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH$→_{135℃}^{浓硫酸}$ C4H9OC4H9+H2O
正丁醚(C4H9OC4H9)是惰性溶剂,常用作有机合成反应溶剂.某实验小组利用如图装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH$→_{135℃}^{浓硫酸}$ C4H9OC4H9+H2O| 药品名称 | 性态 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 液体 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 液体 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注 | 正丁醇易溶于饱和氯化钙溶液中,而正丁醚微溶 | ||||
查看答案和解析>>
科目: 来源: 题型:解答题

| 装置 | 目的 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 溶解度 化学式 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KC104 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KC1 | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/l00gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
 苯甲酸和苯甲酸钠均是食品防腐剂.某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应.
苯甲酸和苯甲酸钠均是食品防腐剂.某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应.
 +2NaOH-→HCOONa+
+2NaOH-→HCOONa+ +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
 某实验小组利用如下装置合成化工原料正丁醛.发生的反应如下:
某实验小组利用如下装置合成化工原料正丁醛.发生的反应如下:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

查看答案和解析>>
科目: 来源: 题型:解答题
 在工业中利用镁制取硅:2Mg+SiO22MgO+Si,同时有副反应发生:2Mg+SiMg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体.如图是进行Mg与SiO2反应的实验装置:
在工业中利用镁制取硅:2Mg+SiO22MgO+Si,同时有副反应发生:2Mg+SiMg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体.如图是进行Mg与SiO2反应的实验装置:查看答案和解析>>
科目: 来源: 题型:解答题
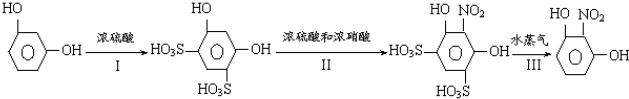

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com