
科目: 来源: 题型:解答题

| 名称 | 形状 | 熔点(℃) | 沸点(℃) | 密度(g•mL-1) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 112.4(100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
| 温度/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.2 | 0.3 | 2.2 |

查看答案和解析>>
科目: 来源: 题型:解答题
 苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理如图1和实验主要装置如图2:
苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理如图1和实验主要装置如图2:| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
 实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H3PO4(浓)+NaH2PO4+HBr、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H3PO4(浓)+NaH2PO4+HBr、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目: 来源: 题型:填空题
 实验室制备硝基苯的步骤如下:
实验室制备硝基苯的步骤如下:查看答案和解析>>
科目: 来源: 题型:填空题
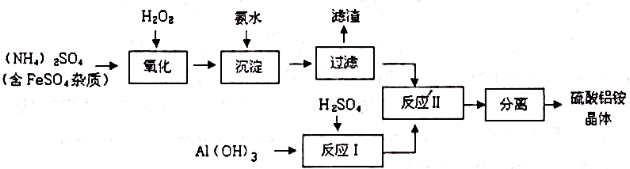

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com