
科目: 来源: 题型:选择题
| A. | 4种 3种 | B. | 4种 2种 | C. | 3种 3种 | D. | 3种 2种 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ),乳酸在微生物作用下分解为CO2和H2O.
),乳酸在微生物作用下分解为CO2和H2O.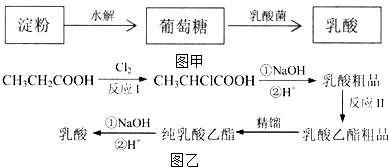
 乳酸在一定条件下发生反应得到聚乳酸的化学方程式是n
乳酸在一定条件下发生反应得到聚乳酸的化学方程式是n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:多选题
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种不溶物的Ksp相差越小,不溶物就越容易转化为更难溶的不溶物 | |
| C. | AgI比AgCl更难溶于水,所以AgCl可以转化为AgI | |
| D. | 一定温度下,向AgCl的饱和溶液中加入NaCl固体,有AgCl固体析出 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 实验编号 | 煅烧温度(℃) | 煅烧时间(h) |
| ① | 550 | 2 |
| ② | 600 | 1 |
| ③ | 650 | 2 |
| ④ | 700 | 3 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 含有大量SO42-的溶液中肯定不存在Ag+ | |
| B. | 0.02 mol•L-1的AgNO3溶液与0.02 mol•L-1的Na2SO4 溶液等体积混合不会生成沉淀 | |
| C. | Ag2SO4的溶度积常数(Ksp)为1×10-3 | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | NaCl固体 | C. | NaOH溶液 | D. | CaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com