
科目: 来源: 题型:选择题
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )| A. | W在周期表中的位置是第三周期,ⅤA族 | |
| B. | 原子半径Q>R>T | |
| C. | W原子得电子能力强于Q原子,且可形成共价化合物QW2 | |
| D. | 原子序数比R多1的元素只有一种氢化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
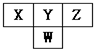 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | Z元素的最高价氧化物的水化物的酸性最强 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.
100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.查看答案和解析>>
科目: 来源: 题型:多选题
 一氧化碳和氢气反应可生成甲醛:CO(g)+H2(g)?HCHO(g)△H<0,一定温度下,向恒容密闭容器中充入等物质的量的H2、CO和HCHO三种气体,测得CO的净反应速率(即正反应速率减去逆反应速率)随时间的变化曲线如图所示,其中第5min和第7min时分别改变了反应的一个条件,下列说法正确的是( )
一氧化碳和氢气反应可生成甲醛:CO(g)+H2(g)?HCHO(g)△H<0,一定温度下,向恒容密闭容器中充入等物质的量的H2、CO和HCHO三种气体,测得CO的净反应速率(即正反应速率减去逆反应速率)随时间的变化曲线如图所示,其中第5min和第7min时分别改变了反应的一个条件,下列说法正确的是( )| A. | 前4 min阴影部分的值为CO的物质的量浓度的变化量 | |
| B. | 前4 min反应向正方向进行 | |
| C. | 第5 min时改变的条件可能为向容器中再分别充入1 mol H2、1 mol CO和1 mol HCHO | |
| D. | 第7 min时改变的条件可能为降低反应温度 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目: 来源: 题型:解答题
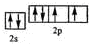 ,该元素的名称是氧.
,该元素的名称是氧.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com