
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24L煤油(设为C8H18)中含有4.816×1023个碳原子 | |
| B. | 常温常压下,O2和O3的混合物16g中含有6.02×1023个氧原子 | |
| C. | 25℃时,1L 0.1mol•L-1的氢氧化钠溶液中含有6.02×1023个OH- | |
| D. | 0.5mol CH4中含有3.01×1023个电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素 | R | W | X | Y | Z |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 离子还原性:Y2-<Z- | B. | 离子半径W+>Z- | ||
| C. | 气态氢化物稳定性:RH4<XH4 | D. | 酸性:H2YO4<HZO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
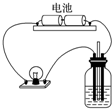
| A. | 向AgNO3溶液中通入少量HCl | B. | 向H2SO3溶液中通入Cl2 | ||
| C. | 向FeI2溶液中通入少量Cl2 | D. | 向NaOH溶液中通入少量Cl2 |
查看答案和解析>>
科目: 来源: 题型:解答题
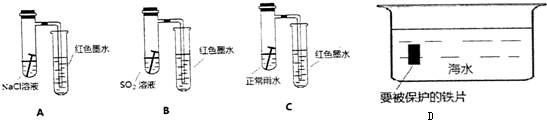
查看答案和解析>>
科目: 来源: 题型:选择题
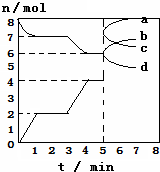 炼铁的还原剂CO是由焦炭和CO2反应而得,现将焦炭与CO2放入体积为2L的密闭容
炼铁的还原剂CO是由焦炭和CO2反应而得,现将焦炭与CO2放入体积为2L的密闭容| A. | 3min时温度由T1升高到T2,则Q>0,重新平衡时K(T2):K(T1)=14﹕3 | |
| B. | 当容器内的压强不变时,该反应一定达到平衡状态,且$\frac{P(平衡)}{P(开始)}$<1 | |
| C. | 0~1min,v(CO)=1mol/(L•min);1~5min时,v正(CO)=v逆(CO2) | |
| D. | 5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 L CO的质量小于1 L O2的质量 | |
| B. | 常温下9 g H2O中所含原子数为1.5NA | |
| C. | 标准状况下,1mol任何物质体积均为22.4L | |
| D. | OH-的摩尔质量为17 g |
查看答案和解析>>
科目: 来源: 题型:解答题




查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com