
科目: 来源: 题型:填空题
 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.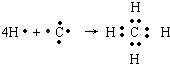 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 根据原子结构、元素周期表和元素周期律的知识回答下列问题:
根据原子结构、元素周期表和元素周期律的知识回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:解答题
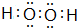 ;试用电子式表示原子个数比为2:1的该化合物的形成过程
;试用电子式表示原子个数比为2:1的该化合物的形成过程 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11575 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与比它原子序数小的稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.4 g | B. | 2.8 g | ||
| C. | 4.4 g | D. | 在1.4 g和2.8 g之间 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将水加热到100℃时,水的pH=6 | B. | 向水中滴加少量稀H2SO4 | ||
| C. | 向水中加入少量NaHCO3 | D. | 向水中加入少量胆矾晶体 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com